1 ВВЕДЕНИЕ
NAC считается безопасным и хорошо переносится большинством детей и взрослых при пероральном, внутривенном или ингаляционном введении. В системном кровообращении 66-87% препарата связывается с белками плазмы. Предполагается, что большая часть дозы NAC метаболизируется и включается в виде цистеина в клеточные пулы. Средний конечный период полувыведения раствора для внутривенного введения составляет 5,6 ч, в то время как средний период полувыведения таблетированной формы составляет 18,1 ч. У людей почечный клиренс составляет примерно 30% от общего клиренса без метаболитов в моче, в то время как только примерно 3% ацетилцистеина выводится с калом.
В данной статье будут обобщены современные знания о способности NAC улучшать симптомы и невропатологии, связанные с различными психическими расстройствами, включая синдром дефицита внимания и гиперактивности (СДВГ), тревогу, биполярное расстройство, депрессию, обсессивно–компульсивное расстройство (ОКР), расстройство, связанное с обсессивно–компульсивными состояниями (OCRD), посттравматическое стрессовое расстройство (ПТСР) и шизофрению. Точный механизм действия, лежащий в основе способности NAC вызывать нейробиологические изменения, не был достоверно определен на разных моделях. Мы надеемся, что этот обзор раскроет общие особенности дозы и поведенческой эффективности NAC и молекулярные изменения на животных моделях психических расстройств, а также предоставит последние данные о его эффективности в клинических исследованиях пациентов с психическими расстройствами.
2 МЕХАНИЗМ ДЕЙСТВИЯ
l-цистеин быстро окисляется до цистина и используется в качестве субстрата антипортера цистин/глутамат (система xC−). Цистин транспортируется в клетку и обменивается на глутамат, регулируя уровни внеклеточного глутамата. Внутри клетки цистин восстанавливается до цистеина, лимитирующего скорость компонента ключевой эндогенной антиоксидантной молекулы GSH. Возможные прямые или косвенные механизмы действия NAC связаны с регуляцией (i) нейротрансмиссии несколькими нейротрансмиттерами, (ii) окислительным гомеостазом и (iii) медиаторами воспаления.
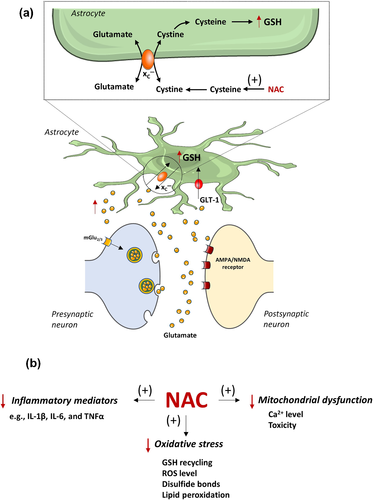
РИСУНОК 1
Механизмы действия N-ацетилцистеина (NAC). NAC вызывает усиление активности цистин/глутаматного антипортера (xC−) и повышает уровень GSH, параллельно с увеличением базального высвобождения глутамата с последующей активацией метаботропных или ионотропных глутаматных рецепторов (a). Действие NAC связано со снижением уровня 2+ Ca в митохондриях и токсичностью, а также снижением окислительного стресса. NAC также подавляет воспалительные цитокины, такие как IL-6 или TNFα (b). ↑— повышенный; ↓—пониженный; GLT-1—переносчик глутамата 1
Регуляция нескольких нейротрансмиттеров
2.1.1 Глутамат
Дисфункция синтеза, высвобождения, синаптических уровней и рециркуляции глутамата, а также активация глутаматных рецепторов (NMDA или mGlu2 и mGlu3) играют важную роль во многих нейропсихиатрических расстройствах, включая шизофрению, депрессию и зависимость. NMDA-рецепторы играют решающую роль в эксайтотоксическом повреждении, связанном со многими формами повреждения нейронов и дегенерации. Система xC−, которая преимущественно экспрессируется в астроцитах головного мозга, является важным элементом в механизме, контролирующем внеклеточный глутамат и высвобождение глутамата. Более того, активация пресинаптического рецептора mGlu2/3 регулирует высвобождение глутамата из нейрональных окончаний.
Несколько результатов ясно показали, что NAC прямо и косвенно модулирует глутаматергическую нейротрансмиссию. NAC дозозависимо активирует систему xC- и нормализует глутаматергическую нейротрансмиссию за счет повышения внеклеточных уровней глутамата за счет транспорта глутамата из глиальных хранилищ во внеклеточное пространство. Это увеличение уровней глутамата впоследствии модулирует экстрасинаптические рецепторы iGlu и / или mGlu. Фактически, регулируя эту систему и передачу сигналов пресинаптического рецептора mGlu2/3, NAC оказывает большее благотворное воздействие на животных моделях шизофрении и наркомании. Примечательно, что при низком уровне внеклеточного глутамата происходит пониженная базальная стимуляция рецептора mGlu2 / 3, что, вероятно, приводит к повышенному высвобождению глутамата в синапсе. Таким образом, активируя систему xC−, NAC повышает уровни внеклеточного глутамата и участвует в восстановлении тормозного тонуса пресинаптических рецепторов mGlu2 / 3, что, в свою очередь, уменьшает высвобождение глутамата в пресинаптических нейронах. Кроме того, NAC повышает уровень цистина, который восстанавливается до цистеина и индуцирует выработку GSH. NAC ингибирует NMDA-опосредованное повышение внутриклеточных уровней кальция через GSH и может вытеснять связывание лиганда с рецепторами NMDA и AMPA. Кроме того, NAC участвует в регуляции уровня глутамата через транспортер глутамата 1-го типа (GLT-1). Фактически, GLT-1 отвечает за наибольшую долю нейронного транспорта глутамата и контролирует клиренс глутамата. Этот механизм особенно важен у лиц с расстройствами, связанными с употреблением психоактивных веществ, поскольку введение NAC восстанавливает прилежащий уровень глутамата и ослабляет восстановление поведения, связанного с поиском кокаина.
Взятые вместе, эти роли NAC в регуляции передачи сигналов глутамата оказывают благотворное терапевтическое воздействие на людей с нервно-психическими расстройствами. Клинические испытания показали, что NAC нормализует уровни глутамата и изменяет уровни GSH и других маркеров (глутамата и глицина) у пациентов, страдающих психическими расстройствами
2.1.2 Дофамин
Известно, что дофаминовая система связана с патофизиологией многих расстройств, таких как шизофрения, зависимость, депрессия и СДВГ. Все больше данных свидетельствует о роли NAC как непрямого регулятора высвобождения дофамина посредством глутаматергической нейротрансмиссии, которая действует через пресинаптические рецепторы mGlu2 / 3, расположенные преимущественно на терминалях нейронов; NAC также, по-видимому, играет важную роль в регуляции дофаминергической системы у лиц с психическими расстройствами. Кроме того, дофамин и его окисленные метаболиты могут оказывать цитотоксическое и нейротоксическое действие на нейроны, подверженные окислительному стрессу, в то время как NAC, антиоксидант и предшественник GSH, может обращать вспять изменения уровней дофамина на животных моделях шизофрении.
2.1.3 Серотонин
Кроме того, на животной модели шизофрении было показано, что NAC ослабляет галлюциногенные эффекты 1-(4-йодо-2,5-диметоксифенил)пропан-2-амина (DOI), агониста 5-НТ2А рецептора. Наблюдаемый подавляющий эффект NAC был отменен ингибитором системы xC− или антагонистом рецепторов mGlu2/3. Эти результаты указывают на то, что NAC является потенциальным регулятором системы 5-НТ посредством взаимодействий между глутаматергической и серотонинергической нейротрансмиссией.
Регуляция окислительного гомеостаза
Изменения окислительно-восстановительного статуса, включая повышение уровня АФК или снижение уровня эндогенных антиоксидантов, относятся к патологическому состоянию, наблюдаемому при нескольких психиатрических и неврологических расстройствах, Фактически, мозг уникально уязвим к АФК из-за его высокого метаболизма кислорода и ограниченных антиоксидантных возможностей. Высокореактивные соединения (т.е. гидроксильные радикалы, перекись водорода, супероксид и пероксинитрит) вызывают окислительную клеточную дисфункцию посредством различных процессов, включая перекисное окисление липидов, инактивацию ферментов, дисфункцию дыхательной цепи митохондрий, модификацию ДНК и / или гибель клеток. Митохондрии играют решающую роль в выработке АТФ посредством многочисленных окислительно-восстановительных реакций, которые способствуют образованию АФК в клетке и приводят к окислительной дисфункции. С другой стороны, антиоксидантные биомаркеры играют решающую роль в нейтрализации действия АФК и регулировании окислительного баланса клеток и функции митохондрий . NAC, донор цистеина, необходимый для образования GSH, играет ключевую роль в гомеостазе окислительного стресса, и цикл цистеин / цистеин также может функционировать как система прямого удаления свободных радикалов. GSH содержит свободную тиоловую группу со снижающей активностью. GSH восстанавливает супероксидные радикалы до перекиси водорода, которая детоксифицируется каталазой до воды, и окисляет GSH до GSSG. Следовательно, регулируя GSH, NAC участвует в нескольких клеточных процессах, включая контроль выработки АФК, перекисное окисление липидов, рециркуляцию GSH, восстановление дисульфидных связей, фолатный цикл и метилирование/
Несколько доклинических исследований показали, что NAC контролирует выработку GSH и его уровень, а лечение NAC устраняет поведенческий дефицит, наблюдаемый у животных с истощением GSH и восстанавливает уровни GSH в лобной коре и полосатом теле на животных моделях от шизофрении. Аналогичным образом, NAC значительно улучшает антиоксидантную защиту у крыс с депрессивным поведением и / или зависимостью от кокаина.
Регуляция медиаторов воспаления
Несколько доклинических и клинических исследований задокументировали участие NAC в регуляции уровней воспалительных цитокинов. NAC регулирует экспрессию воспалительных цитокинов (мРНК) и секрецию (белка) при различных воспалительных состояниях (например, липополисахаридов и уксусной кислоты) in vitro и in vivo. NAC, предшественник GSH и прямой антиоксидант, ингибирует активацию NF-κB и других провоспалительных цитокинов, которые подавляют различные провоспалительные гены. NAC значительно подавляет высвобождение IL-1β, индуцируемое липополисахаридами и ослабляет секрецию IL-10 и выработку IL-8 путем отмены транскрипционной активации IL-8, Более того, он полностью устраняет изменения в уровнях цитокинов, вызванные социальной изоляцией, например, повышением уровней IL-6 и IL-4 и снижением уровней TNF-α и IFN-γ
Клинические испытания указывают на защитный эффект NAC при воспалительных процессах. Лечение NAC снижает сывороточные уровни С-реактивного белка (CRP), IL-6, IL-8 и TNF-α и оказывает многообещающее воздействие на другие биомаркеры воспаления, то есть хемокин CCL2, молекулу межклеточной адгезии 1 и молекулу адгезии клеток сосудов 1. Однако значительное снижение уровней провоспалительных цитокинов после перорального приема NAC по сравнению с внутривенным введением было обнаружено нелегко, и введение NAC в дозах 400-2000 мг в день -1 и длительность вмешательства 1-80 недель оказывали соответствующее влияние на биомаркеры воспаления